7
月8日,藥監總局發布《總局關于發布2016年第一批
醫療器械臨床試驗監督抽查項目的通告(2016年第105號)》。
依據《關于開展醫療器械臨床試驗監督抽查工作的通告》(2016年第98號),總局抽取了等10個注冊申請項目,將對其臨床試驗數據的真實性和合規性實施回顧性監督檢查。
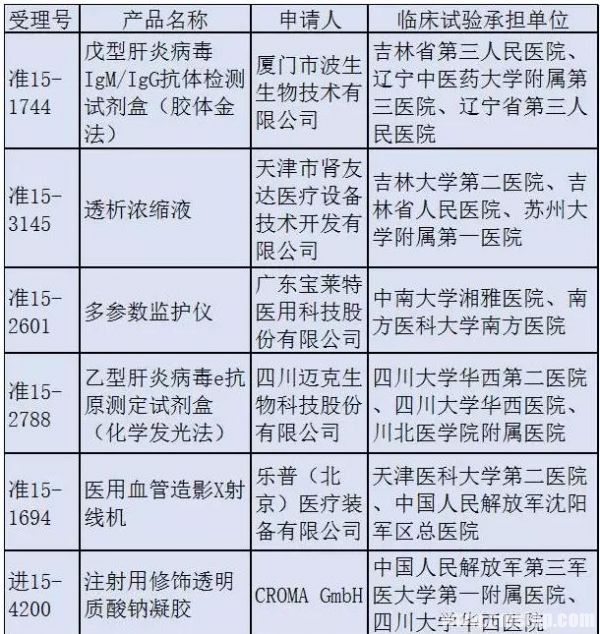
10個待查項目中,一半國產、一半進口。申請人中既有樂普醫療這樣的國產龍頭,也有波士頓科學這樣的外資巨頭。而臨床試驗承擔單位更是清一色的國內知名大醫院。 ?
這也是98號通告發布之后,第一批接受總局抽查的醫療器械臨床試驗項目。具體檢查時間安排和抽查的臨床試驗機構將由總局食品藥品審核查驗中心另行通知。 ?
這樣的安排,若是知名企業和醫院核查出問題,無疑頗能“殺雞給猴看”。在去年橫掃藥物領域的醫械臨床試驗核查大風暴中,也正是因為有知名大醫院的涉嫌造假被查,而快速打破了藥企紛紛觀望的局面,主動撤回注冊申請的藥企數量短期內大增。 ?
當然,以總局首批抽查的這10家醫療器械企業的過往、規模等來看,被查出問題的可能性應該很小。 ?
一切靜待檢查結果出爐! ?
醫療器械臨床試驗的核查會成為今年行業整頓重點,這一點包括總局局長畢井泉亦曾公開表態。 ?
而截至目前,除了總局密集出臺各種相關政策文件,包括《醫療器械臨床試驗質量管理規范》(以下簡稱《規范》)、醫械臨床試驗檢查要點等等,在地方,北京、山東、湖北、湖南這四個省份,已經展開了醫療器械臨床試驗的自查核查。其中,湖北、湖南是在前不久才啟動的。
此外,7月7日,浙江省藥監局發布《浙江省食品藥品監督管理局、浙江省衛生和計劃生育委員會關于貫徹實施<醫療器械臨床試驗質量管理規范>的通知》(浙食藥監規〔2016〕12號)以及《醫療器械臨床試驗管理備案》辦事流程文件。從2016年6月1日起,在浙江開展醫療器械臨床試驗的申辦者、臨床試驗機構和研究者應嚴格按照《規范》要求開展臨床試驗。 ?
浙江是第一個在CFDA發布《規范》之后,發出貫徹實施《規范》通知的省份。之后,應會有其他省份陸續跟進。 ?
總局的抽查加上地方的自查、核查,以及貫徹落實《規范》通知的出爐...未來幾個月,醫械臨床試驗數據真實性核查風暴,將席卷全國。